一、选择题:本题共16小题,共44分。第1-10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 文物记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是 ( )
B.28g晶体硅中含有2molSi-Si键
C.HCl中化学键为s-sσ键 D.碳的同素异形体金刚石和
![]()
5.宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是 ( )
8.我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。
10. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是 ( )
![]()
B.W与X的化合物存在氢键
将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生
13. 陈述I和陈述Ⅱ均正确且具有因果关系的是 ( )
![]()
示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法正确的是 ( )
15. 我国科技工作者利用计算机模拟N2在不同催化剂,以及硫酸作电解质溶液的条件下,电解还原制备氨气反应历程中相对吉布斯自由能变化如图所示(*代表微粒吸附在催化剂表面)。下列说法错误的是 ( )
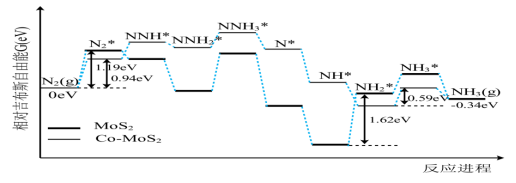
C. 从热力学趋势来说该反应能自发进行 D. 该历程的总反应为
![]()
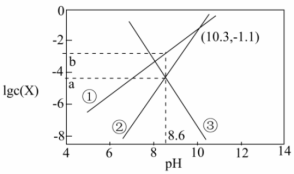
16.天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知Ksp(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为
![]()
![]()
或Ca2+)与pH变化的关系如图所示。下列说法不正确的是 ( )
![]()
,曲线; B.a=-4.35,b=-2.65
(2)向新制Cu(OH)2的悬浊液滴加少量乙醛,并加热,写出其反应化学方程式:__________________
(5)H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
(6)联氨(N2H4)是一种常用的还原剂。其氧化产物一般为N2。联氨可用于处理高压锅炉水中溶解的氧,防止锅炉被腐蚀。理论上1.0 kg的联氨可除去水中溶解的O2___________kg。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_____________。(计算结果保留两位小数)
18(14分).某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是。
氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强;还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小
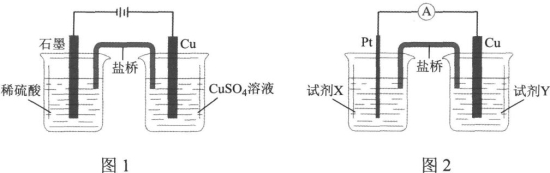
据此,小组分别利用电解池(图1)和原电池(图2)装置,成功实现了铜与稀硫酸制氢气。
19.(14分)锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。下图是以锗锌矿(主要成分为
质量比)对沉锗的影响如表所示,选择最佳加料量为____________(填“10-15”“15-20”或“20-25”)。
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线r pm,阿伏加德罗常数的值为
丹参酮系列化合物是中药丹参的主要活性成分,具有抗菌消开云官方 kaiyun官方网炎、活血化瘀、促进伤口愈合等多种作用,其衍生物J的合成路线)E中含有的官能团名称:________________。
(2)A→B的化学方程式为____________________________________________________。

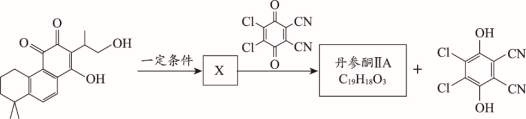
(3)2Fe(OH)3+3ClO-+4OH-===2FeO42-+5H2O+3Cl- 2分
![]()
②MnO2+2e-+4H+===Mn2++2H2O2分 ③MnO2氧化性减弱(1分)
(4)bd (2分)
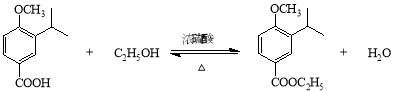
(7) C19H20O3 (1分)

